Las colisiones son perfectamente elásticas; cuando dos moléculas chocan, cambian sus direcciones y energías cinéticas, pero la energía cinética total se conserva. Las colisiones no son “pegajosas”. La energía cinética promedio de las moléculas de gas es directamente proporcional a la temperatura absoluta.
¿Qué sucede cuando las moléculas de gas chocan?
Las partículas de gas están en un estado constante de movimiento aleatorio y se mueven en línea recta hasta que chocan con otro cuerpo. Las colisiones que exhiben las partículas de gas son completamente elásticas; cuando dos moléculas chocan, la energía cinética total se conserva.
Cuando las partículas de gas chocan, ¿qué sucede con la energía?
La energía cinética puede transferirse de una partícula a otra durante una colisión elástica, pero no hay cambio en la energía total de las partículas que chocan. No hay fuerzas de atracción o repulsión entre las partículas de gas.
¿Pierden energía las moléculas cuando chocan?
Todas las colisiones entre moléculas de gas son perfectamente elásticas; toda la energía cinética se conserva. Cuando los autos chocan, se pierde energía al doblar los parachoques y el metal. Las moléculas no actúan así. En cambio, actúan como bolas de billar.
¿Las partículas de gas pierden la mayor parte de su energía durante una colisión?
Las partículas de gas chocan constantemente entre sí y con las paredes de su contenedor. Estas colisiones son elásticas; es decir, no hay pérdida neta de energía por las colisiones. Las partículas de gas son pequeñas y el volumen total ocupado por las moléculas de gas es insignificante en relación con el volumen total de su contenedor.
¿Qué hace que las moléculas de gas se muevan más lentamente?
Dado que todos los gases tienen la misma energía cinética promedio a la misma temperatura, las moléculas más ligeras se mueven más rápido y las moléculas más pesadas se mueven más lentamente en promedio. Teoría cinética molecular de los gases (cont.) ). Está cerca (pero no exactamente igual) de la velocidad promedio de las moléculas.
¿Cuál de las siguientes moléculas de gas tiene el camino libre medio más largo?
Entonces, como el hidrógeno tiene la masa molar más pequeña, también tiene el camino libre medio más grande.
¿Los gases reales pierden energía cinética?
Las partículas de gas están en movimiento continuo y aleatorio. Las colisiones entre partículas de gas son completamente elásticas. En otras palabras, no hay pérdida o ganancia neta de energía cinética cuando las partículas chocan. La energía cinética promedio es la misma para todos los gases a una temperatura determinada, independientemente de la identidad del gas.
¿Cuando un gas es ideal no hay pérdida de energía durante las colisiones?
Las partículas de un gas ideal no ejercen fuerzas de atracción entre sí ni sobre su entorno. Así, las colisiones que exhiben las partículas de gas son completamente elásticas; cuando dos moléculas chocan, la energía cinética total se conserva. Pregunta 8 (1 punto) Cuando un gas es ideal, no hay pérdida de energía durante las colisiones.
¿A qué temperatura las moléculas no tienen energía y dejan de moverse?
A cero kelvin (menos 273 grados centígrados) las partículas dejan de moverse y todo desorden desaparece. Por lo tanto, nada puede ser más frío que el cero absoluto en la escala Kelvin.
¿Qué determina la energía cinética promedio de las moléculas de cualquier gas?
La energía cinética promedio de las partículas en un gas es proporcional a la temperatura del gas. Si se mueven más rápido, las partículas ejercerán una fuerza mayor sobre el recipiente cada vez que golpean las paredes, lo que provoca un aumento de la presión del gas.
¿Cómo se llama cuando las partículas de gas golpean la pared?
La teoría cinética molecular se puede utilizar para explicar cada una de las leyes de los gases determinadas experimentalmente. El vínculo entre P y n. La presión de un gas resulta de las colisiones entre las partículas de gas y las paredes del recipiente. Cada vez que una partícula de gas golpea la pared, ejerce una fuerza sobre la pared.
¿Qué sucede con las partículas de gas cuando se comprime un gas?
Los gases son comprimibles porque la mayor parte del volumen de un gas se compone de grandes cantidades de espacio vacío entre las partículas de gas. Cuando se comprime un gas, como cuando se llena el tanque de buceo, las partículas de gas se ven forzadas a acercarse.
¿Cuál es la capacidad de las moléculas de gas para propagarse rápidamente?
Las partículas gaseosas están en constante movimiento aleatorio. Las partículas gaseosas tienden a sufrir difusión porque tienen energía cinética. La difusión es más rápida a temperaturas más altas porque las moléculas de gas tienen mayor energía cinética. La efusión se refiere al movimiento de partículas de gas a través de un pequeño orificio.
¿La temperatura afecta la energía cinética de las moléculas de gas?
De acuerdo con la Teoría Cinética Molecular, un aumento en la temperatura aumentará la energía cinética promedio de las moléculas. A medida que las partículas se mueven más rápido, es probable que golpeen el borde del recipiente con más frecuencia. El aumento de la energía cinética de las partículas aumentará la presión del gas.
¿Qué sucede cuando las partículas de un gas ideal chocan?
Las partículas de gas están en un estado constante de movimiento aleatorio y se mueven en línea recta hasta que chocan con otro cuerpo. Las colisiones que exhiben las partículas de gas son completamente elásticas; cuando dos moléculas chocan, la energía cinética total se conserva.
¿Cuál de las siguientes es correcta para la Ley de Boyles?
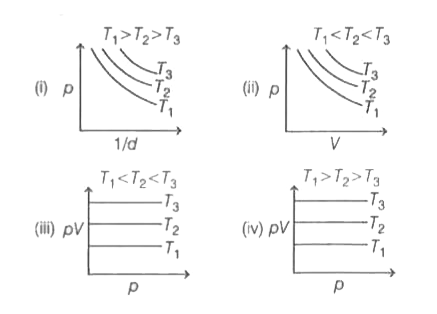 Por lo tanto, las gráficas (ii) y (iii) son correctas. Por lo tanto, la opción (d) es la respuesta correcta.
Por lo tanto, las gráficas (ii) y (iii) son correctas. Por lo tanto, la opción (d) es la respuesta correcta.
¿De qué depende la energía interna de un gas ideal?
La energía interna y la entalpía de los gases ideales dependen únicamente de la temperatura, no del volumen ni de la presión. Aplicando relaciones de propiedad se demuestra que la energía interna y la entalpía de los gases ideales no dependen del volumen y la presión, respectivamente.
¿Es un cambio isotérmico al que obedece un gas ideal?
La expansión isotérmica continúa mientras la fuerza aplicada disminuya y se agregue el calor apropiado para mantener pV = 2. Se dice que la expansión es internamente reversible si el movimiento del pistón es lo suficientemente lento como para que en cada instante la temperatura y la presión del gas sean uniformes y conformes. a la ley de los gases ideales.
¿Cuáles son los cinco supuestos de un gas ideal?
La ley de los gases ideales supone que los gases se comportan idealmente, lo que significa que se adhieren a las siguientes características: (1) las colisiones que ocurren entre las moléculas son elásticas y su movimiento es sin fricción, lo que significa que las moléculas no pierden energía; (2) el volumen total de las moléculas individuales es magnitudes más pequeñas
¿Qué hacen las moléculas de gas cuando pierden energía?
La condensación ocurre cuando las moléculas en un gas se enfrían. A medida que las moléculas pierden calor, pierden energía y disminuyen su velocidad. Se acercan a otras moléculas de gas. Finalmente, estas moléculas se juntan para formar un líquido.
¿Cuáles son los 5 supuestos de la teoría cinética de los gases?
Los cinco postulados principales del KMT son los siguientes: (1) las partículas en un gas están en constante movimiento aleatorio, (2) el volumen combinado de las partículas es insignificante, (3) las partículas no ejercen fuerzas entre sí, (4) cualquier colisión entre las partículas es completamente elástica, y (5) la energía cinética promedio de
¿Qué gas tiene el valor máximo del camino libre medio?
El camino libre medio es la distancia media recorrida por una molécula entre dos colisiones sucesivas. Obviamente, la molécula de menor tamaño molecular tendrá mayor camino libre medio. Por lo tanto, la elección correcta es (a), H2.
¿Cuál es el camino libre medio de la molécula?
El camino libre medio es la distancia promedio recorrida por una molécula en movimiento entre colisiones.
¿Qué tiene el valor máximo del camino libre medio?
Las moléculas con tamaño pequeño poseen el camino libre medio máximo.